Proteínas recombinantes monobiotiniladas
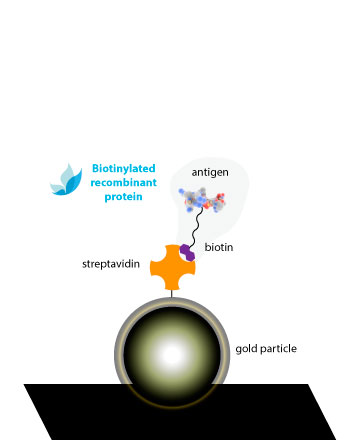
En Rekom Biotech hemos desarrollado una línea de proteínas monobiotiniladas, ofreciendo algunas de las referencias de nuestro catálogo con una biotina en su extremo C-terminal. Esta molécula permite la unión específica de las proteínas biotiniladas a la estreptavidina.
Nuestras proteínas monobiotiniladas están unidas a un BCCP-tag en el extremo C-terminal, con un residuo de lisina que es biotinilado enzimáticamente por la biotina ligasa BirA de E. coli. Esta técnica de marcado de un solo punto tiene muchas ventajas para los ensayos de unión más comunes:
- La biotinilación solo ocurre en el residuo de lisina del BCCP tag.
- No hay interferencia con las uniones de la proteína objetivo.
- La orientación de las proteínas es uniforme cuando se inmoviliza sobre una superficie recubierta de estreptavidina, como las nanopartículas.
Echa un vistazo a nuestras proteínas monobiotiniladas y no dudes en ponerte en contacto con nosotros si necesitas cualquier cosa.
Sistemas convencionales de conjugación
Un antígeno conjugado puede ser una solución útil para varios problemas que pueden surgir durante el desarrollo de una nueva prueba IVD. Un problema común causado por la mayoría de las superficies es la desnaturalización de las proteínas debido a su alta hidrofobicidad superficial.
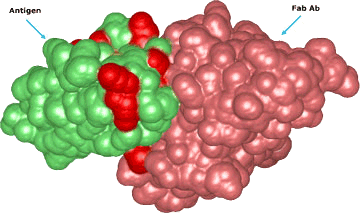
Además, los eventos de unión pueden verse afectados por la posición de la superficie y las moléculas del sensor, lo que podría causar un mayor impacto estérico. Además, colocar las moléculas en una orientación específica podría mejorar la estabilidad de las proteínas unidas y hacer que el ensayo sea más sensible al exponer sus regiones antigénicas.
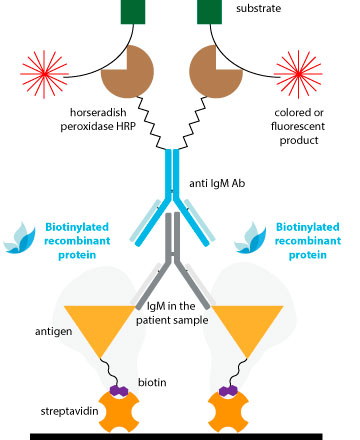
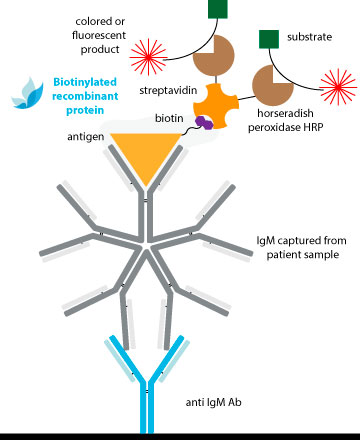
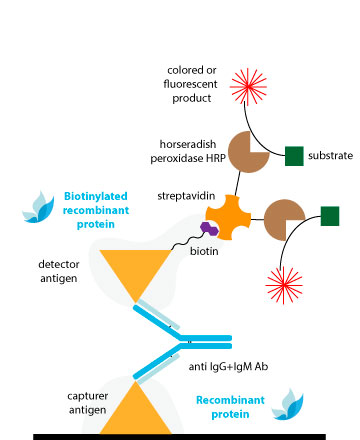
Los métodos tradicionales de conjugación son efectivos para los anticuerpos, pero es posible que no brinden resultados consistentes para los antígenos con estructuras menos establecidas. Esto puede explicar por qué Los ELISA del tipo sándwich de doble antígeno (DAgS) no se usan tan ampliamente para detectar anticuerpos en comparación con ELISA.
Para evitar comprometer la estructura antigénica y la sensibilidad de los DAS-ELISA debido a la conjugación química convencional, la solución ideal es utilizar proteínas monobiotiniladas.
¿Por qué usar nuestras proteínas monobiotiniladas?
La unión extremadamente específica y de alta afinidad entre la biotina y la avidina y/o estreptavidina (Kd ≈ 10-14M) da lugar a sistemas de detección de alta sensibilidad. Una ventaja clara es que, con sólo una estreptavidina conjugada con peroxidasa, podemos obtener conjugados complejos de todas nuestras referencias sin necesidad de peroxidar cada una..
La biotina va unida a un linker que la separa de la superficie de la proteína, evitando posibles impedimentos estéricos con las regiones antigénicas presentes en la superficie de la proteína. De esta manera, la interacción con el anticuerpo no se verá comprometida con la conjugación.
Al unir siempre una biotina por molécula de proteína, nuestras proteínas biotiniladas presentarán una mayor reproducibilidad y esto favorecerá a la reproducibilidad de los test de diagnóstico desarrollados con ellas.
Usos de las proteínas monobiotiniladas