
Rekom Biotech
Calidad
Rekom Biotech se compromete a garantizar el más alto nivel de calidad en el diseño y fabricación de nuestros reactivos IVD.
Rekom Biotech se compromete a garantizar el más alto nivel de calidad en el diseño y fabricación de nuestros reactivos IVD. Nuestros productos están diseñados, desarrollados, fabricados y distribuidos de acuerdo con nuestro sistema de calidad, el cual está certificado por las normas ISO 9001 e ISO 13485. Nuestros reactivos IVD son fabricados de acuerdo a Procedimientos Operativos Estándar (POEs) y son sometidos a un riguroso control de calidad en nuestros laboratorios. Puedes consultar nuestra política del sistema si estás interesado.
Estamos autorizados a trabajar con organismos genéticamente modificados (OGM), con el número de licencia A/ES/19/I-22, emitida por la Comisión Nacional de Bioseguridad.
Estamos registrados como PYME INNOVADORA.
Controles de calidad
Cada lote se somete a diversos controles de calidad:
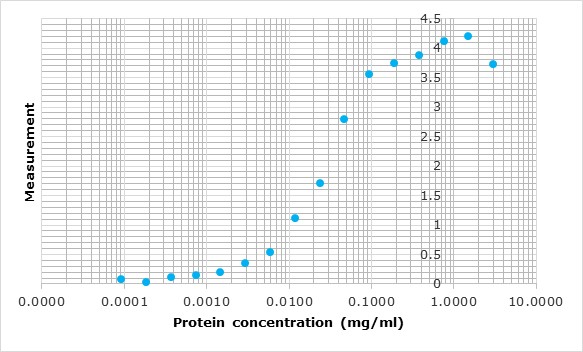
Como nosotros diseñamos las proteínas, conocemos la secuencia exacta de amino ácidos de cada proteína, esto nos permite la determinación directa de los coeficientes de extinción teóricos según Gill y vonHippel, 1989. Preferimos determinar la concentración de las proteínas midiendo la absorbancia a 280 nm a la utilización de métodos colorimétricos como los métodos de Lowry o Bradford, que siempre hacen referencia a una curva de calibrado con BSA u otra proteína estándar.
Sin embargo, para las proteínas que no contienen residuos de Trp, es posible obtener más de un 10% de error en el cálculo del coeficiente de extinción. Por lo tanto, en estos casos concretos, medimos la concentración de proteína utilizando el ensayo colorimétrico basado en la interacción entre el azul brillante de Coomassie y la arginina y los residuos aromáticos (método de Bradford) con un cambio de absorción máximo de 470 nm a 595 nm (Bradford, 1976).
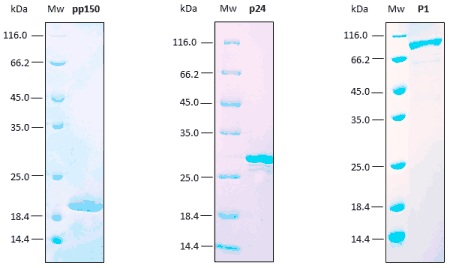
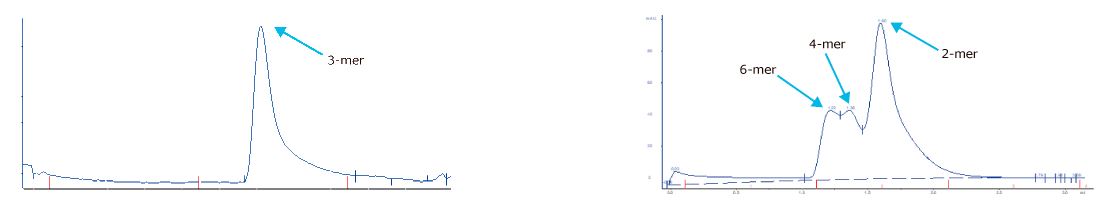
Los análisis de reproducibilidad se realizan mediante ensayos SDS-PAGE, SEC y ELISA. Excelente replicabilidad del proceso de producción.
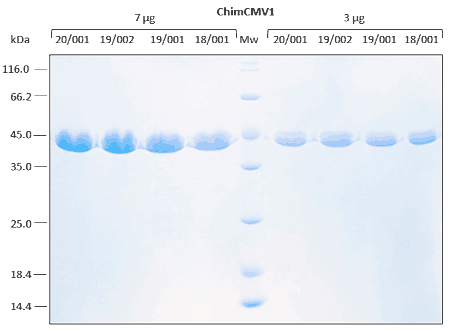
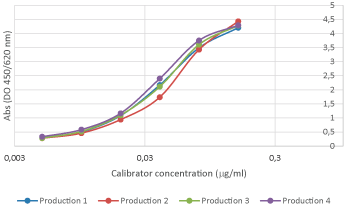
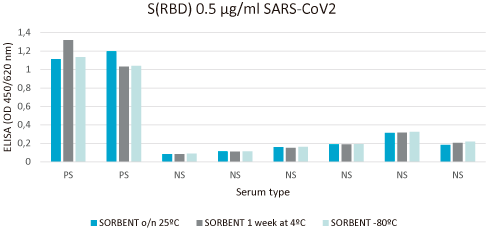
Se realiza una estabilidad relativa con análisis de inmunoensayo en diferentes condiciones ambientales.
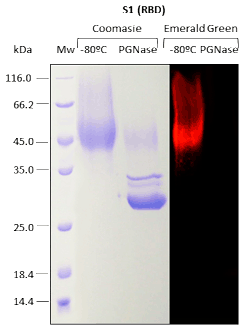
Para las proteínas recombinantes producidas en Pichia pastoris, se analizan la N-glicosilación y la O-glicosilación.

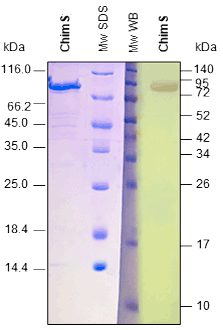
Western BLOT
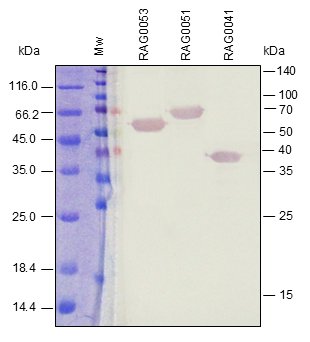
ELISA
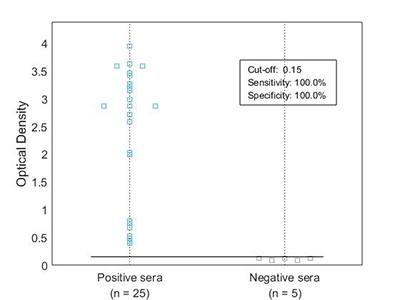
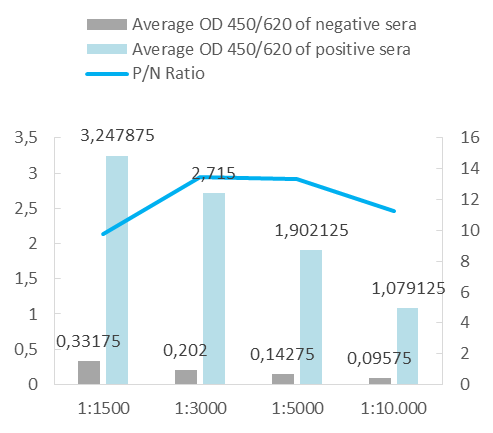
Nuestros antígenos monobiotinilados in vivo se analizan con un ensayo western blot con estreptavidina conjugada (A) y varios ensayos ELISA (B), un ensayo ELISA indirecto en placas de microtitulación recubiertas con estreptavidina (figura 1B), y un ensayo ELISA captura con el antígeno recombinante biotinilado utilizado como detector con estreptavidina-HRP (figura 2B).

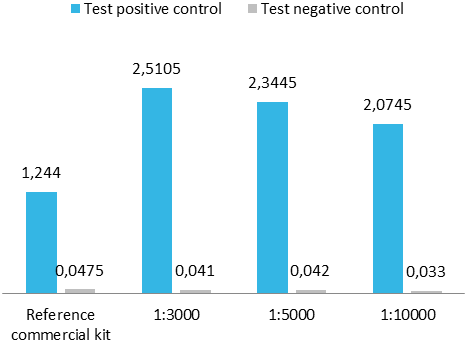
Por requerimiento de algún cliente o como control de calidad interno de un formato de captura de ELISA, en ocasiones conjugamos nuestros antígenos con peroxidasa. Para su análisis, realizamos un ensayo ELISA de captura utilizando una prueba comercial y un ensayo in house.
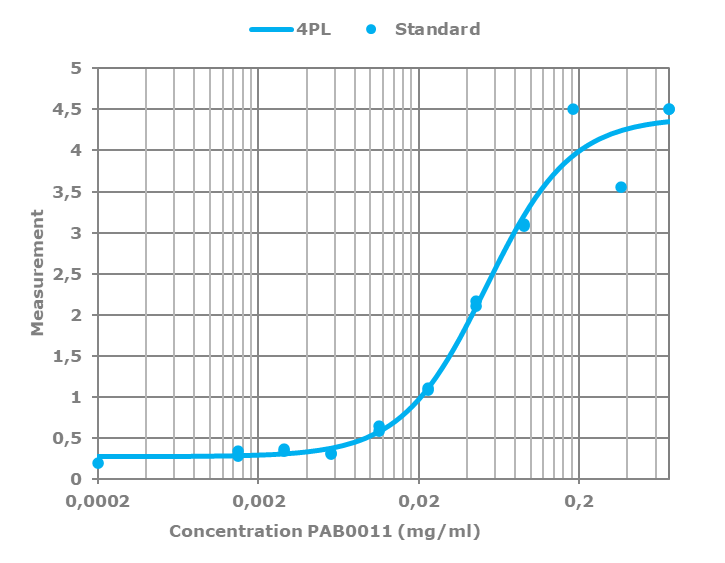
Todos los anticuerpos policlonales se titulan frente a su inmunógeno, cambiando la concentración del anticuerpo frente a una cantidad fija de inmunógeno en placa. Posteriormente, la curva obtenida se ajusta a una regresión logística de 4 parámetros, o 4PL.
Potencia tu laboratorio con reactivos a medida
En Rekom Biotech diseñamos y fabricamos reactivos IVD, de alta calidad, validados y versátiles, para diagnósticos in vitro confiables y eficaces.
-
[[carrito.product.name]]
- [[sku.sku]]
O si lo prefieres...
Como fabricantes, podemos adaptar nuestros productos a tus necesidades.
-
[[carrito.product.name]]
- [[sku.sku]]
Como fabricantes, podemos adaptar nuestros productos a tus necesidades.
¡Contáctanos!
